


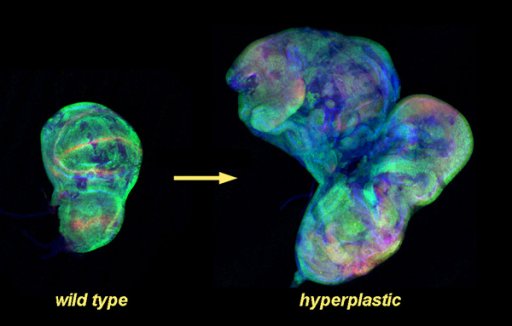
Dans les tissus sains, les comportements des cellules, tels que la prolifération et l'adhésion, sont étroitement contrôlés, garantissant une croissance harmonieuse des tissus et des organes. Ce contrôle est effectué par des interactions cellulaires et des échanges d’information à courte et à longue distance qui doivent ensuite être intégrés. Invariablement, les cellules cancéreuses s'adaptent et échappent à ces régulations strictes pour proliférer et pour envahir les tissus environnants ou distants. A l'aide d'approches et de modèles expérimentaux complémentaires, l'équipe «Prolifération et polarisation des cellules épithéliales» cherche à comprendre comment les signalisations à courte et longue distance sont intégrées dans les cellules épithéliales et comment leurs altérations contribuent au développement des tumeurs. Plus spécifiquement, l'équipe vise à mieux comprendre:
1. la fonction des protéines d’assemblages apicales dans la régulation des voies de signalisation cellulaire et de l'adhésion
2. les signaux à courte distance orientant les cellules vers la prolifération ou la mort
3. la signalisation cellulaire à longue distance et l'influence des réponses systémiques sur le comportement des cellules cancéreuses.
| Responsable : Alexandre Djiane Institut de Recherche en Tél. : 33 (0)4 67 61 24 41 |



