Le laboratoire étudie les interactions entre architecture cellulaire (principalement via le rôle des protéines d‘assemblage apicales) et signalisation intercellulaire (principalement Notch et Hippo) dans le contrôle de la croissance des tissus épithéliaux. Notre stratégie consiste d’abord à utiliser l’organisme modèle Drosophila melanogaster pour effectuer des observations originales et disséquer leur mode d’action grâce aux outils génétiques puissants disponibles chez la drosophile, puis à étendre nos observations à des modèles pertinents pour le cancer: lignées de cellules cancéreuses et modèles modèle préclinique.
Objectifs 1 et 2
Nous étudions le rôle de deux familles de protéines d’assemblage à domaines PDZ dont les homologues humains sont altérés dans les cancers: Magi/MAGI et Big-bang/PDZD2. En combinant différentes approches génétiques, protéomiques et cellulaires (principalement par l'utilisation de mosaïques génétiques où des tissus normal et mutant se juxtaposent dans un même organisme), nous avons montré que:
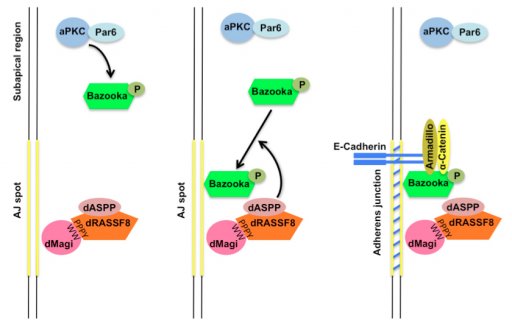
- Magi chez la drosophile, via son association avec les protéines RASSF8 et ASPP, contrôle le recrutement membranaire de Bazooka/Par3, garantissant ainsi l'intégrité des jonctions apicales à E-Cadhérine. Des défauts de Magi provoquent des jonctions interrompues, des défauts de remodelage, et une insensibilité à la mort cellulaire par apoptose (Zaessinger et al., Development 2015; Coopman et al., Cell Mol. Life Sci. 2016).
- Bbg chez la drosophile, en partie par son interaction avec des modeleurs de l'Actine tels que les Spectrines, favorise l'enrichissement apical en F-Actine corticale et la stabilisation de la phospho-myosine II activée, entraînant une augmentation de la tension corticale apicale. Nos études suggèrent que cette tension, via une signalisation Hippo alternative, favorise l'activité de Yki/YAP et la prolifération cellulaire (Forest et al., J. Cell Biol. 2018).
Les homologues humains de Magi et de Bbg ont été décrits comme des suppresseurs de tumeurs potentiels et nous étudions actuellement leurs rôles dans les cancers du sein et du côlon.
Objectifs 2 et 3
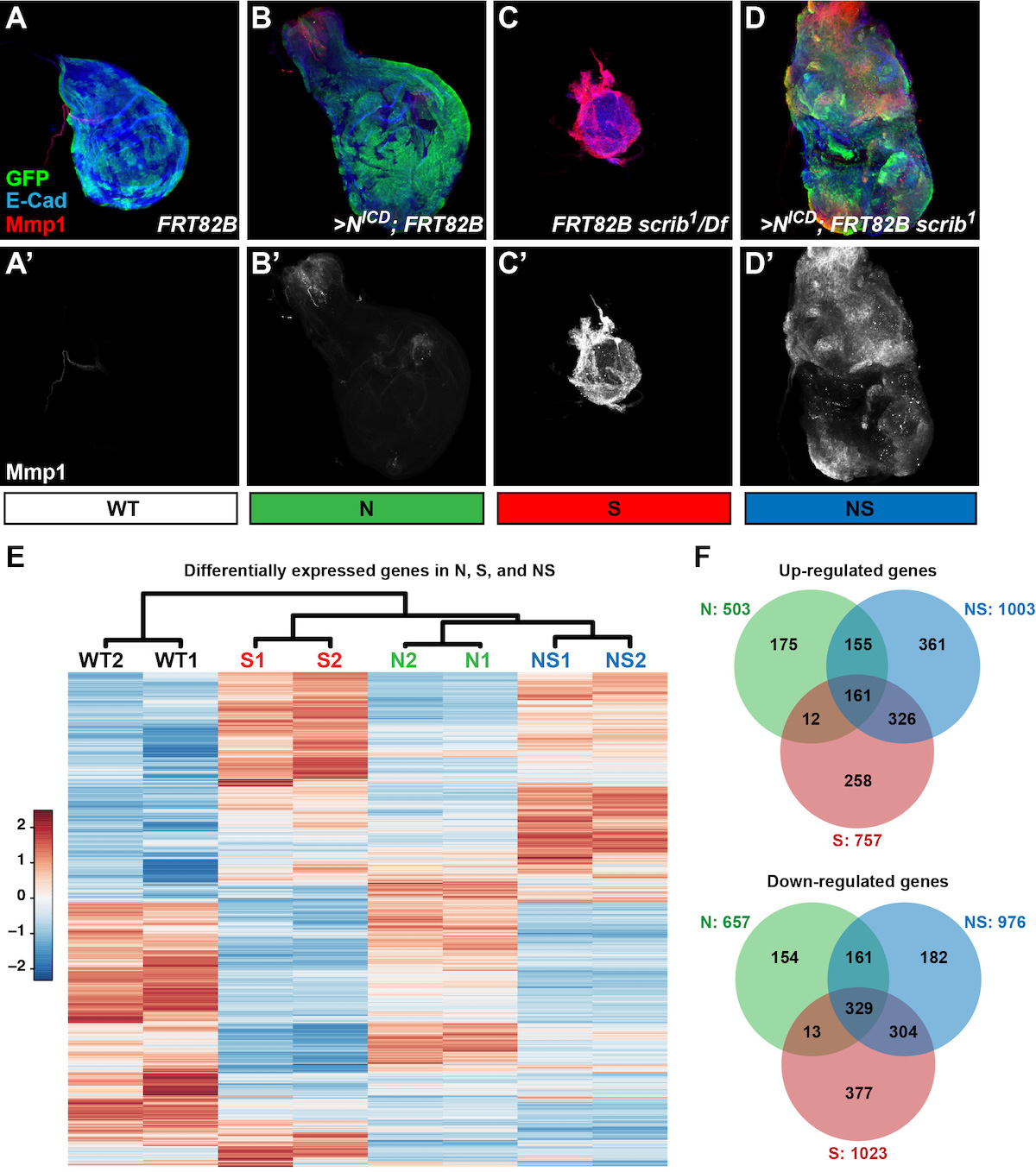
Pour mieux comprendre les mécanismes par lesquels les interactions cellulaires à courte et longue distance contrôlent les comportements des cellules épithéliales (prolifération, migration, apoptose…), nous étudions la coopération entre l’activation oncogénique des voies de signalisation (ici l’activation de Notch) et les altérations de polarité cellulaire (par la mutation du gène suppresseur de tumeur scrib) pour générer une croissance néoplasique. En utilisant comme modèle le disque d'aile de drosophile, le laboratoire a développé des paradigmes originaux de prolifération: des disques hyperplasiques avec Notchact activé (N), des disques dysplasiques mutants pour scrib- (S), et des disques néoplasiques combinant Notchact & scrib- (NS). Nous utilisons ces différents paradigmes de croissance pour étudier:
- comment différentes mutations interagissent au sein d'une même cellule pour mieux comprendre l'évolution des cellules cancéreuses
- quels comportements cellulaires contrôlent la transition d'une croissance hyperplasique (bénigne) à une croissance néoplasique (maligne)
- par quels mécanismes les cellules cancéreuses entrent en compétition avec les cellules «normales» ou entre elles pour sélectionner les clones les plus agressifs
- quels programmes métaboliques soutiennent ces différents modes de surcroissance.