


Chaque année, le cancer du poumon tue environ un million de personnes dans le monde, et on estime qu’à ce rythme 250 millions de personnes mourront de cette maladie au cours du 21ème siècle. Environ 40% des patients atteint du cancer du poumon développent un adénocarcinome. Les trois altérations génomiques majeures dans ces adénocarcinomes sont les mutations oncogéniques dans les gènes KRAS et EGFR, et la translocation EML4-ALK qui sont retrouvées chez plus de 50% de patients des pays occidentaux et jusqu’à 80% des patients de certains pays asiatiques comme la Corée.
Le laboratoire a précédemment démontré que les adénocarcinomes du poumon induit par l'oncogène K-Ras sont dépendants de la voie Notch, et que l'inhibition pharmacologique de cette voie par l’utilisation d’inhibiteur de g-secretase (GSI) bloque la croissance des tumeurs K-Ras dépendantes in vivo. Ces résultats sont très encourageant car aujourd'hui en clinique il n'existe pas de traitement ciblé pour ce type d’adénocarcinome. Dans le but d'étendre cette découverte à d'autres types d’altérations génétiques dans l'adénocarcinome du poumon humain, nous avons obtenu au cours de ces dernières années des modèles modèle préclinique pour étudier l'adénocarcinome du poumon induit par plusieurs autres oncogènes tels que EGFR, EML4 / ALK et c-MET.
A titre d'exemple des travaux réalisés dans le laboratoire, la figure ci-dessous représente des coupes de tissu issues de poumon de modèle préclinique avec des tumeurs portant les mutations EGFRT790M/L858R. Nous montrons que les adénocarcinomes diminuent partiellement après un traitement de ces modèles précliniques par la g-secretase DBZ (inhibiteur de Notch), et restent inchangés après traitement au géfitinib comme prévu puisque la mutation EGFRT790M confère une résistance à ce TKI. En revanche et de façon intéressante lorsque les deux médicaments sont combinés, la croissance tumorale est fortement inhibée due à la resensibilisation de ces tumeurs au géfitinib.
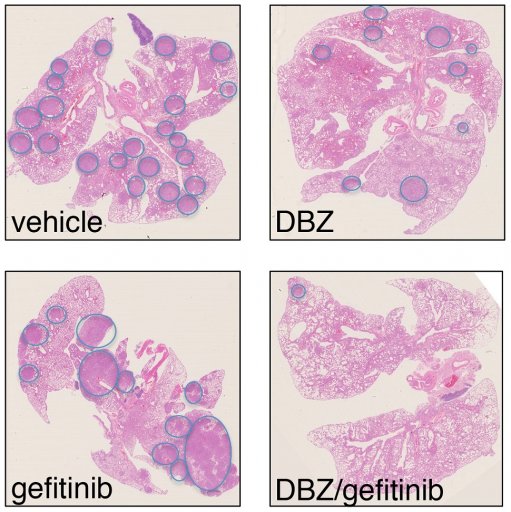
Nous démontrons que l’inhibition de la voie Notch peut également resensibiliser ces adénocarcinomes EGFRT790M ou EGFRC797S aux TKIs: gefitinib et osimertinib respectivement. Ces données offrent une nouvelle opportunité thérapeutique aux patients porteurs de mutations EGFR qui, après traitement par TKI, rechutent et n’ont pas d’autre possibilité thérapeutique que la chimiothérapie conventionnelle peu efficace. En résumé, en combinant l'utilisation de différents inhibiteurs de tyrosines kinases ciblant la dépendance des tumeurs aux oncogènes, à d’autres inhibiteurs de voies non oncogéniques telle que la voie de signalisation Notch, nous avons obtenu des données solides in vivo mettant en évidence l'effet de cette approche thérapeutique dans l'adénocarcinome du poumon induit par l'EGFR.
Notre intérêt s’étend désormais aux facteurs oncogéniques EML4 / ALK et c-MET et nous essayons de comprendre comment les tumeurs présentant ce type d’altérations développent une résistance in vivo à des TKI dédiés tels que l’alectinib pour les tumeurs dépendantes de ALK et le merestinib pour les tumeurs dépendantes de c-MET. De plus, nous étudions si l’inhibition de Notch pourrait également être bénéfique en combinaison avec le traitement à base de sel de platine donné actuellement en première ligne de traitement aux patients atteints d’adénocarcinome du poumon provoqué par KRAS. La chimiothérapie à base de sel de platine constitue également la dernière option pour les patients EML4 / ALK ou EGFR qui rechutent suite aux traitements par des TKIs de dernière génération.
Notre objectif principal est donc de développer de nouveaux traitements pour lutter contre le cancer du poumon et de les intégrer rapidement en clinique en réalisant des essais innovants de phase 1 à l'ICM, hôpital situé sur notre campus. Nous entamons d’ailleurs actuellement une procédure afin de mettre en œuvre un essai clinique à l’ICM associant l’osimertinib et les inhibiteurs de Notch.
Nos résultats sont très encourageants mais encore beaucoup de questions restent posées et en voici quelques unes que nous aimerions aborder dans le laboratoire au cours des prochaines années :
1) Comment cibler la voie de Notch d’une manière plus rationnelle, c’est-à-dire en affectant au minimum les cellules non tumorales?
2) Comment éviter la génération de résistance à une thérapie ciblée?
3) Quelle est la contribution du stroma au développement de la résistance et / ou à l'activation de la voie Notch dans les cellules cancéreuses?
4) Quels sont les mécanismes de résistance à l'inhibition de Notch dans l'adénocarcinome du poumon?
5) Comment contrecarrer la résistance à l'osimertinib induite par MET dans l'adénocarcinome du poumon EGFR dépendant?
6) Quelle est le lien entre épigénétique et la voie Notch dans l'adénocarcinome du poumon?