Les interactions entre cellules garantissent une croissance harmonieuse et un fonctionnement optimal des tissus et des organes. Invariablement, les cellules cancéreuses s'adaptent et échappent à ces régulations strictes pour proliférer et pour envahir les tissus environnants ou distants. A l'aide d'approches et de modèles expérimentaux complémentaires, l'équipe «Croissance épithéliale et cancer» cherche à comprendre comment les signalisations à courte et longue distance sont intégrées dans les cellules épithéliales et comment leurs altérations contribuent au développement des tumeurs. Plus spécifiquement, nous étudions:
1. le rôle de voie de signalisation inhibitrice de tumeurs Hippo, et comment elle est régulée
2. la compétition cellulaire et son influence sur la composition des tissus et des tumeurs
3. les interactions entre la tumeur et l’organisme, en particulier au cours de la cachexie.
Projet 1 : Voie de signalisation Hippo (L. Heron-Milhavet / A. Djiane)
La signalisation Hippo est une voie suppresseur de tumeurs souvent dérégulée dans les cancers. Nous avons montré chez la drosophile que la protéine apicale Bbg régule le cytosquelette d’actine sous-cortical et participe à l’activité de Yki, le facteur de transcription terminal de la voie (homologue de YAP et TAZ ; Forest et al., J. Cell Biol. 2018). Nous avons également montré que la protéine apicale MAGI1, régule les activités de la voie Hippo et de la voie P38 dans les cellules de cancer du sein de type luminal (Kantar et al., Sci Reports 2021).
Nous étudions actuellement le lien entre les voies Hippo et P53 dans la résistance aux chimiothérapies dans le cancer colorectal.
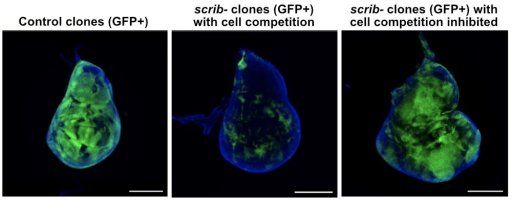
Projet 2 : Relations écologiques entre cellules : compétition cellulaire (P. Lassus / A. Djiane)
Nous nous intéressons au phénomène de compétition cellulaire qui aboutit à l’élimination des cellules les plus faibles (perdantes) par les cellules les plus fortes (gagnantes). Ce mécanisme permet d’optimiser un tissu et représente un mécanisme anti-tumoral pour éliminer localement les cellules pré-cancéreuses. La compétition cellulaire a aussi été impliquée dans l’évolution des tumeurs et la sélection des sous-clones les plus agressifs.
Par différentes approches omiques (RNA/prot/metabo) et des screens génétiques, nous cherchons à identifier de nouveaux régulateurs de la compétition cellulaire et des voies de réponses au stress, permettant l’élimination des cellules pré-néoplasiques.
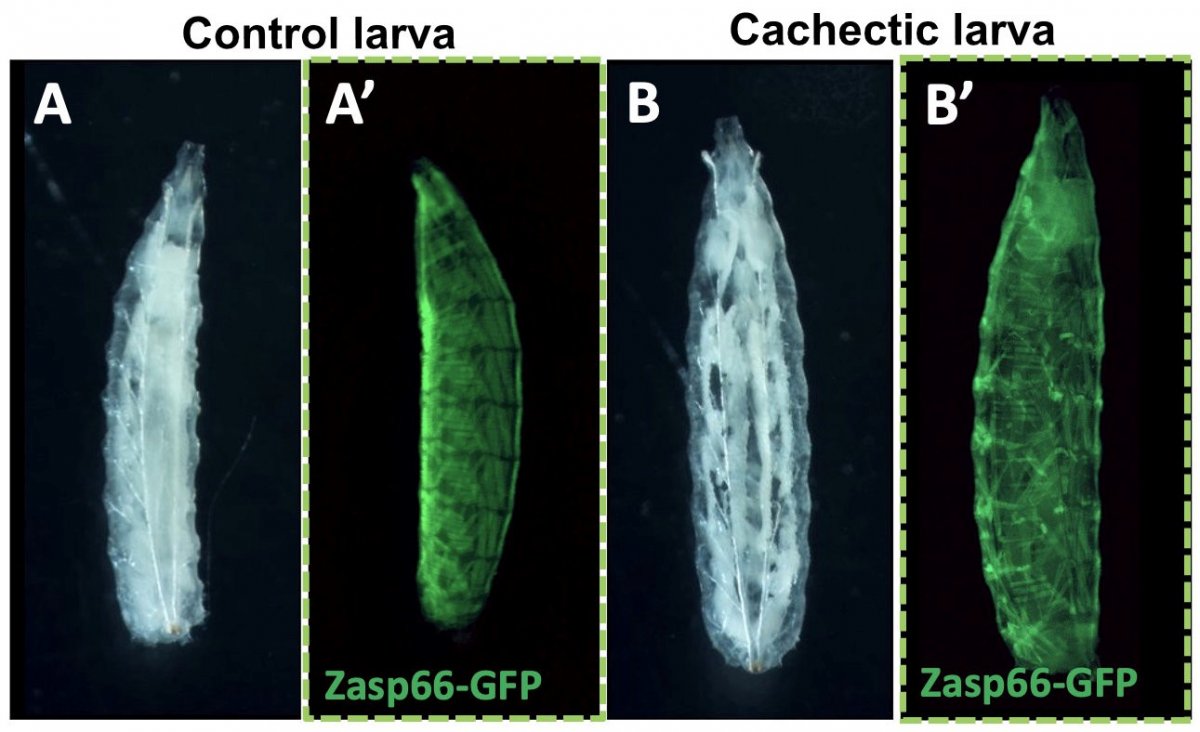
Projet 3 : Communications inter-organes pendant la cachexie associée au cancer (C. Géminard / P. Senesse / A. Djiane)
Nous avons développé des modèles de cachexie chez la larve de drosophile en réponse à des tumeurs restreintes aux disques d’ailes. Ils présentent les caractéristiques de la cachexie: atrophie du tissu adipeux (le tissu blanc sur la figure), désorganisation musculaire (marqueur live Zasp66-GFP), hyperglycémie et inflammation. En utilisant ces modèles originaux, nous visons à identifier les messages échangés entre la tumeur et les organes affectés qui médient la cachexie. En parallèle, nous utilisons des modèles murins classiques de cachexie (tumeurs du colon C26 et tumeurs pancréatiques KPC), et des échantillons de patients, pour tester la pertinence clinique de nos résultats.