


Les projets de l’équipe* sont centrés sur les cancers du sein triple-négatifs (CSTN) pour lesquels la découverte de nouveaux traitements est un indispensable. Notre recherche intégrée et multidisciplinaire vise: (i) au niveau fondamental à déterminer comment l’organisation du microenvironnement des CSTN est affecté par les protéases et leurs substrats/fragments bioactifs libérés par une approche de protéomique N-TAILS; (ii) au niveau translationnel à perturber le dialogue tumeur/stroma en ciblant ces protéines ou fragments bioactifs identifiés avec des anticorps propriétaires et des conjugués anticorps-médicaments (ADC); et (iii) au niveau pré-clinique à sélectionner des sous-groupes de CSTN pour un traitement ciblé et/ou combiné avec des anticorps. Notre but prioritaire est que nos découvertes fondamentales se concrétisent en applications cliniques pour traiter certains sous-types de CSTN de façon personnalisée.
*L’équipe est intégrée au LabEx MAbImprove depuis 2011 (http://mabimprove.univ-tours.fr) et au PEPR Accredia depuis 2023.
Axe 1 : Reprogrammation de la matrice extracellulaire (MEC) par le dialogue tumeur-stroma dans les cancers du sein triple-négatifs (CSTN) via la dérégulation/le clivage des protéines de la MEC (leader, E Liaudet, DR2 INSERM).
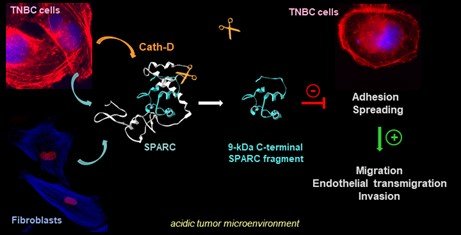
Pour comprendre le dialogue tumeur-stroma affectée par la protéolyse, nous caractérisons le répertoire des substrats de la cathepsine D par des analyses d’OMIC à grande échelle dans le microenvironnement tumoral des CSTN. En utilisant la dégradomique N-TAILS, nous avons découvert ~150 protéines sécrétées extracellulaires, y compris des protéases, des protéines matricellulaires, des récepteurs et d'autres composants de la MEC (et leurs peptides associés), potentiellement impliqués dans l'organisation du microenvironnement des CSTN. Ces données protéomiques seront analysées par bioinformatique pour prédire les substrats candidats, évaluer leur interaction au niveau moléculaire par des approches biochimiques afin d'identifier de nouvelles cibles pour une thérapie à base d'anticorps. Nos analyses de N-TAILS ont déjà démontré que la protéine matricellulaire SPARC est clivée dans sa partie carboxy-terminale par la cathepsine D, ce qui libère un fragment de SPARC de 9-kDa présentant une activité oncogénique exacerbée comparée à SPARC native dans les CSTN [Alcaraz et al, Theranostics, 2021]
Axe 2 : Thérapies innovantes à base d'anticorps modulant l’organisation du microenvironnement tumoral, en ciblant à la fois les cellules cancéreuses et stromales, pour le traitement des CSTN (leaders, T Chardès, DR1 Cnrs, V Laurent-Matha, MCU, E Liaudet).
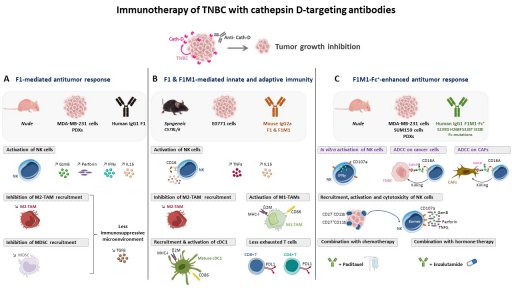
Le traitement des CSTN métastatiques repose essentiellement sur la chimiothérapie, avec des réponses fluctuantes et surtout un échappement rapide. Il est donc indispensable de trouver des cibles moléculaires spécifiques à la tumeur et/ou des stratégies thérapeutiques alternatives pour traiter ces patientes. L'immunothérapie et les conjugués anticorps-médicaments (ADC) sont des options thérapeutiques en plein essor. Nous sélectionnons des cibles d’intérêt du microenvironnement tumoral isolées lors de nos cribles de dégradomics N-TAILS pour développer des anticorps humains innovants et des ADC pour de nouvelles thérapies des CSCN. Nos travaux récents ont démontré les rôles antitumoraux et immunomodulateurs de nos anticorps humains propriétaires ciblant la cathepsine D dans les CSTN [Desroys du Roure*, David*, J. Immunother. Cancer, Commentary, in press]
Axe 3: Sélection des patientes atteintes de CSTN qui pourraient bénéficier d'une thérapie innovante à base d'anticorps et d'ADC (porteurs, S Guiu, MD-PhD, sénologue, ICM, et P Roger, PU-PH, anatomopathologiste, CHU Nîmes)
En raison de l'hétérogénéité des CSTN, il est important d'identifier les sous-groupes éligibles aux thérapies ciblées. Une nouvelle classification des CSTN, basée sur les caractéristiques immunohistochimiques, distingue quatre sous-groupes: luminal androgen receptor-positive (LAR), immunomodulatory (IM), basal-like immunosuppressive (BLIS), et mesenchymal (MES). Avec les médecins, nous analyserons l'expression de nos cibles, identifiées par N-TAILS et validées par ciblage fonctionnel avec des anticorps propriétaires, dans ces quatre sous-groupes par immunohistochimie à partir d’une collection de micropuces de CSTN pour identifier ceux qui pourraient bénéficier d'une thérapie innovante à base d'anticorps et d'ADCs. Notre étude préclinique précédente a montré que le sous-groupe LAR pourrait bénéficier d'une thérapie combinée avec des anti-androgènes et un anticorps anti-cathepsine D [Mansouri*, Alcaraz* et al, Cancers, 2020].